1. ĐẠI CƯƠNG
Tổn thương thận cấp (acute kidney injury, AKI) là sự suy giảm nhanh chức năng thận trong vài ngày tới vài tuần, gây ra sự tích tụ các sản phẩm nitơ trong máu có hoặc không có giảm số lượng nước tiểu. Theo KDIGO, AKI được định nghĩa là tình trạng tăng đột ngột creatinin huyết thanh (serume creatinin, SCr) ít nhất 0,3mg/dL (26.5 mcmol/L) trong vòng 48 giờ hoặc 50% so với SCr nền trong vòng 7 ngày, hoặc thể tích nước tiểu ít hơn 0,5mL/kg/h trong vòng ít nhất 6 giờ. AKI thúc đẩy sự trở xấu tình trạng bệnh và kéo dài thời gian nằm viện của người bệnh, là gánh nặng bệnh tật cho bệnh nhân và xã hội với tử xuất cao. Khoảng 30% AKI tiến triển thành bệnh thận mạn (chronic kidney disease, CKD) và bệnh thận giai đoạn cuối (end-stage renal disease, ESRD). Có nhiều yếu tố làm tăng nguy cơ mắc AKI như tuổi cao, các bệnh lý tim mạch, đái tháo đường, thiếu máu, các tình trạng bệnh nặng, sốc, chấn thương, bỏng, phẫu thuật,… Trong đó việc sử dụng một số nhóm thuốc cũng thúc đẩy nguy cơ này, đặc biệt là các thuốc có độc tính tích lũy trên thận.
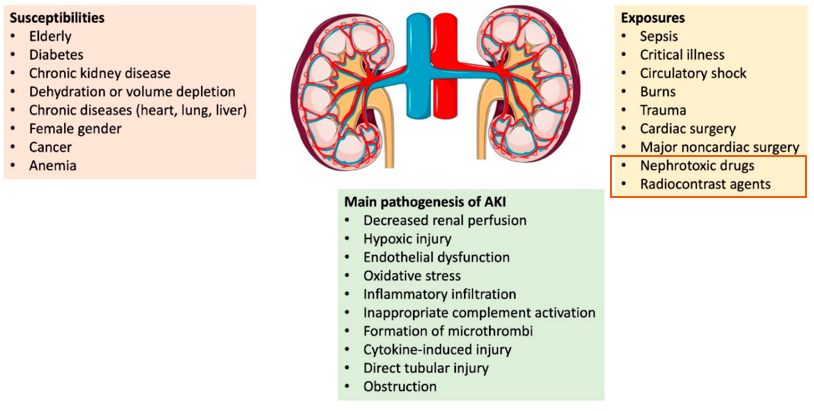
Hình 1. Các yếu tố nguy cơ gây tổn thương thận cấp.
Tổn thương thận do thuốc được ước tính chiếm khoảng 20-30% các trường hợp AKI trên lâm sàng. Các thuốc kháng sinh (glycopeptid, aminoglycosid, colistin) và thuốc cản quang có nguy cơ cao gây AKI, đặc biệt trên những bệnh nhân nặng. Tuy nhiên, việc xác định liên quan giữa thuốc với biến cố AKI trên lâm sàng thường gặp nhiều khó khăn và có nhiều yếu tố đồng ảnh hưởng, trong đó có diễn tiến bệnh và các vấn đề liên quan đến sử dụng thuốc chưa tối ưu.
2. CÁC CƠ CHẾ GÂY TỔN THƯƠNG THẬN CẤP DO THUỐC
Có nhiều cơ chế khác nhau thúc đẩy AKI có liên quan đến thuốc bao gồm các thay đổi huyết động học và các tổn thương tại thận. Trên thực tế, một thuốc có thể gây độc tính cho thận theo một hoặc nhiều cơ chế khác nhau đồng thời. Mức độ biểu hiện trên lâm sàng có thể phụ thuộc tình trạng bệnh, bệnh tim mạch-thận-đái tháo đường đồng mắc, tương tác thuốc, sử dụng thuốc liều cao, trong thời gian dài…
Bảng 1. Cơ chế gây tổn thương thận liên quan đến thuốc

2.1. AKI liên quan đến thay đổi huyết động tại cầu thận
Việc duy trì áp lực lọc tại cầu thận được đảm bảo theo sinh lý chủ yếu là nhờ prostaglandin (PGI2) và angiotensin II, với vai trò lần lượt là giãn tiểu động mạch vào và co tiểu động mạch ra.
Hình 2. Ảnh hưởng của NSAIDs và ACEI đến việc duy trì mức lọc cầu thận
Trong khi các thuốc kháng viêm non-steroid (NSAIDs), cyclosporin ức chế sự thành lập PGI2 dẫn đến mất chức năng dãn tiểu động mạch đến; các thuốc ức chế men chuyển (ACEI) hoặc ức chế thụ thể angiotensin II (ARB) làm giảm khả năng co tiểu động mạch đi. Việc sự dụng phối hợp 2 thuốc này về mặt dược lý có thể làm giảm áp lực lọc tại cầu thận, từ đó thúc đẩy nguy cơ AKI trên lâm sàng. Các bằng chứng lâm sàng đã chứng tỏ nguy cơ AKI dẫn đến nhập viện tăng khi phối hợp NSAIDs và ACEI/ARB, và cao hơn khi phối hợp đồng thời bộ 3 “tripple whammy” gồm NSAIDs, ACEI/ARB và thuốc lợi tiểu.
Tuy nhiên, cần lưu ý rằng các thuốc ức chế renin-angiotensin-aldosterol (ACEI, ARB) chỉ làm thay đổi cơ chế tự điều hòa huyết động tại cầu thận (chủ yếu ở thời điểm khởi đầu) nhưng không ảnh hưởng đến chức năng nephron, do vậy không gây ra tổn thương thận nội tại. Bên cạnh đó, ACEI/ARB được chứng minh là các nhóm thuốc có lợi, giúp làm chậm tiến trình suy thận trên bệnh nhân bệnh thận mạn, đặc biệt là các bệnh nhân có albumin niệu. Mặc dù vậy, một số đối tượng có thể nhạy cảm với giảm tưới máu thận, cần theo dõi chức năng thận chặt chẽ để tầm soát nguy cơ AKI khi sử dụng ACE/ARB, gồm người cao tuổi, chức năng thận nền thấp; bệnh nhân có bệnh lý hẹp động mạch thận; tổn thương động mạch vào sẵn có (đái tháo đường, tăng huyết áp lâu năm); phải sử dụng phối hợp đồng thời nhiều nhóm thuốc ảnh hưởng đến huyết động tại thận (như lợi tiểu, NSAIDs, cylosporin)
2.2. AKI liên quan đến đến các tổn thương thực thể tại thận
2.2.1. Tổn thương liên quan đến huyết khối vi mạch
Một số thuốc có thể thúc đẩy sự hình thành huyết khối tiểu cầu trong vi mạch (microvascular thrombosis) gây bít tắc, bắt đầu từ sự sản sinh các tự kháng thể, sự lắng đọng các phức hợp miễn dịch, tổn thương độc tế bào nội mô mao mạch trực tiếp.
Hình 3. AKI do sự hình thành huyết khối vi mạch
Một số thuốc thúc đẩy AKI do tắc vi mạch: thuốc chống kết tập tiểu cầu (clopidogrel, ticlodipin), thuốc ức chế miễn dịch (cyclosporin), thuốc kháng ung thư (mitomycin-C), quinin… Các tổn thương liên quan đến huyết khối vi mạch thường có thể hồi phục sau khi ngừng thuốc nhưng có thể biến chứng thần kinh/bệnh thận mạn
2.2.2. Tổn thương ống thận do thuốc
Thuốc có thể gây tổn thương ống thận theo 2 cơ chế chính:
- Giảm tái hấp thu các chất từ dịch lọc vào máu: do tiếp xúc/lắng động các chất độc và/hoặc thay đổi phương thức vận chuyển tại ống thận
- Giảm đáp ứng hoạt động của ti thể, tăng stress oxy hóa, tăng tạo các gốc tự do, gây phá hủy cấu trúc mô học, hoại tử ống thận
Một số thuốc thúc đẩy tổn thương ống thận do kháng sinh (aminoglycosid, vancomycin), kháng nấm (amphotericin B), kháng virus: cidofovir, adefovir, tenofovir, thuốc cản quang, ciplastin, zoledronic acid…
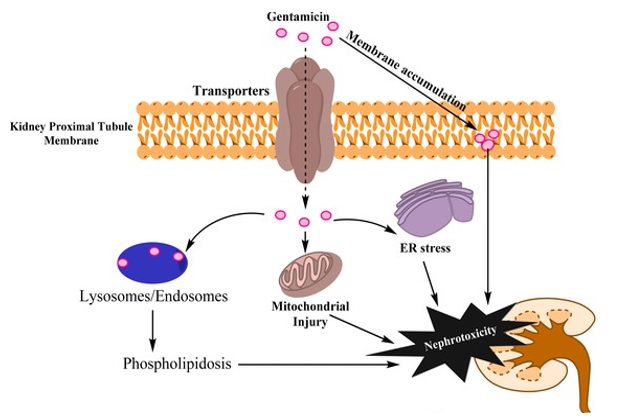
Hình 4. Tổn thương do tích lũy thuốc ở ống thận do kháng sinh aminoglycosid
2.2.3. Các tổn thương viêm tại thận do thuốc
Một số thuốc có nguy cơ gây gây viêm cầu thận cấp qua trung gian phức hợp kháng nguyên-kháng thể đưa đến tình trạng đạm niệu như NSAIDs, lithium, interferon- a,, hydralazine, propylthiouracin, pamidronate…
Một số thuốc cũng có thể gây viêm ống thận mô kẽ cấp theo cơ chế đáp ứng dị ứng, không phụ thuộc liều. Các thuốc gắn với kháng thể tại thận hoặc lắng đọng phức hợp kháng nguyên-kháng thể tại mô kẽ từ đó gây sốt, phát ban, tăng eosinophil: allopurinol, các kháng sinh (beta lactams, quinolone, sulfonamid, vancomycin), kháng virus (acyclovir, indinavir), lợi tiểu (quai, thiazid), NSAIDs, ranitidine,thuốc ức chế bơm proon (omeprazole, pantoprazole…). Bên cạnh đó, một số bệnh nhân cũng có thể biểu hiện tình trạng viêm ống thận mô kẽ mạn và không có triệu chứng rầm rộ khi sử dụng kéo dài một số thuốc như cyclosporin, tacrolimus, thuốc hóa trị, lithium, NSAIDs liều cao >1g/kéo dài >2 năm.
2.2.4. Bệnh thận do tinh thể thuốc
Một số thuốc có nguy lắng đọng tự nhiên hoặc bị lắng đọng trong điều kiện pH dịch lọc hay nước tiểu thay đổi, hoặc nồng độ đáy của thuốc tích lũy cao. Trong tình trạng lắng đọng cấp tính, các tinh thể thuốc có thể gây tổn thường thận cấp; tuy nhiên, nếu tình trạng này kéo dài cũng có thể dẫn đến thúc đẩy bệnh thận mạn.
Hậu quả của bệnh thận do tinh thể thuốc còn có thể gây tổn thương mạch máu, tổn thương ống thận hoặc gây sỏi thận. Tinh thể thuốc có thể kết tinh, lắng đọng tại ống lượn xa, ống góp gây tắc nghẽn ống thận hoặc lắng đọng tại mô kẽ gây viêm mô kẽ. Trên cận lâm sàng, các tinh thể thuốc này có thể phát hiện thông qua xét nghiệm cặn lắng nước tiểu.
Các thuốc có nguy cơ cao: một số kháng sinh (ampicillin, ciprofloxacin, cotrimoxazol), kháng virus (acyclovir, ganciclovir), một số thuốc khác như methotrexat, triamteren…
Các yếu tố làm tăng nguy cơ bệnh thận do tinh thể thuốc: giảm thể tích hoặc thiếu nước; sử dụng thuốc liều cao, kéo dài; truyền nhanh; bệnh thận mạn sẵn có và một số tương tác thuốc làm thay đổi pH của nước tiểu hoặc tạo phức không tan trong nước tiểu như ceftriaxon và calci
Hình 5. Kết tủa một số thuốc qua cặn lắng nước tiểu
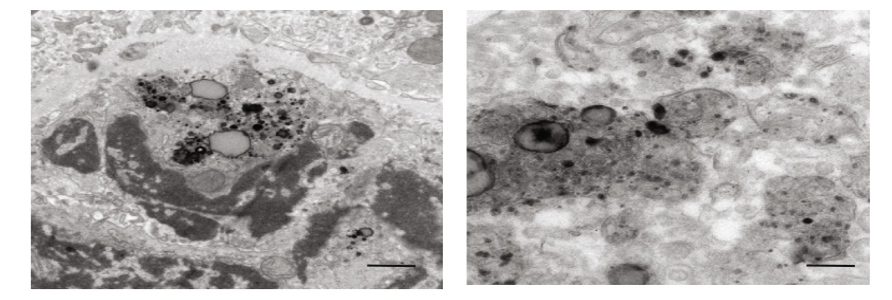
Hình 6. Sự lắng đọng kết tủa ceftriaxon-calci dạng tinh thể tại ống thận
2.2.5. AKI gián tiếp thông qua ly giải cơ vân do thuốc
Sử dụng lâu dài hoặc quá liều một số thuốc (như statin) có nguy cơ gây ly giải cơ vân làm giải phóng myoglobin, tăng creatin kinase, có thể thúc đẩy sự tắc nghẽn ống thận, hoặc hoại tử ống thận cấp. Yếu tố nguy cơ làm độc tính tăng gồm tình trạng thiếu nước, thể trạng gầy, cao tuổi, nghiện rượu, có bệnh lý mạn tính như đái tháo đường, suy thận, suy giáp và tương tác thuốc bất lợi. Sự phối hợp giữa một số statin (như simvastatin) với thuốc ức chế cytochrom P450 (như các macrolid, quinolon, verapamil…) có thể làm tăng nguy cơ độc tính do thuốc.
3. TẦM SOÁT VÀ GIẢM THIỂU NGUY CƠ AKI DO THUỐC
3.1. Đánh giá và tầm soát AKI trên thận: từ cơ chế đến lâm sàng
Phần lớn các thuốc có độc tính thận có thể thúc đẩy nguy cơ tổn thương thận cấp đồng thời theo nhiều cơ chế khác nhau.
Hình 7. Cơ chế tổn thương thận cấp liên quan đến các kháng sinh
Hình 8. Ảnh hưởng kép của NSAIDs liều cao kéo dài trên huyết động và stress oxy hóa tại ống thận
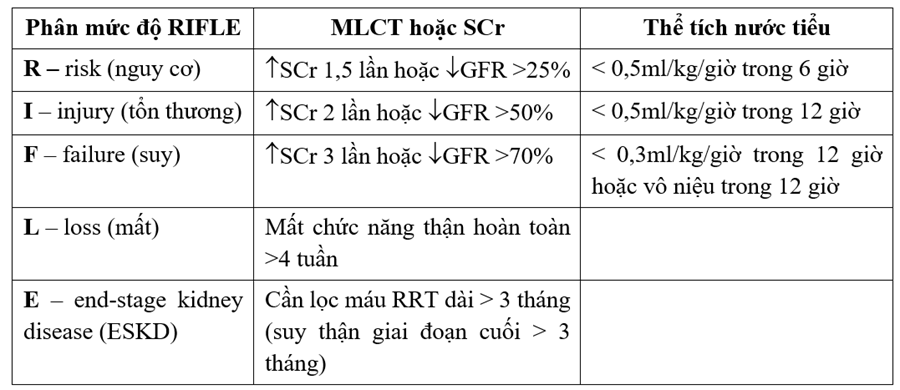
Khi phải sử dụng liều cao, kéo dài các thuốc có nguy cơ cao gây độc tính trên thận, hoặc bệnh nhân là đối tượng có nguy cao cao AKI, người điều trị cần lên kế hoạch theo dõi chức năng thận và nhận diện được các biểu hiện của AKI sớm để có thể giảm thiểu các bất lợi trong quá trình điều trị, bao gồm điều chỉnh việc dùng thuốc cho hợp lý. Thang điểm RIFLE (Risk, Injury, Failure, Loss, End-stage kidney disease) là một công cụ có thể giúp đánh giá tổn thương thận cấp dựa trên các chỉ số huyết áp, lưu lượng dịch và chức năng thận.
Bảng 2. Thang điểm RIFLE đánh giá nguy cơ tổn thương thận cấp
Việc đánh giá liên quan giữa AKI với thuốc thường dựa trên nguyên tắc loại trừ các yếu tố nguy cơ liên quan, bao gồm tình trạng dinh dưỡng, đặc điểm khối cơ, cụt chi, cân bằng dịch, chức năng thận nền… và đánh giá tính hợp lý sử dụng thuốc (liều dùng, khoảng cách dùng, tương tác thuốc) cùng với các dữ liệu về tính an toàn thuốc trên quần thể bệnh nhân cụ thể (suy thận, cao tuổi, ung thư, bệnh nhi…)
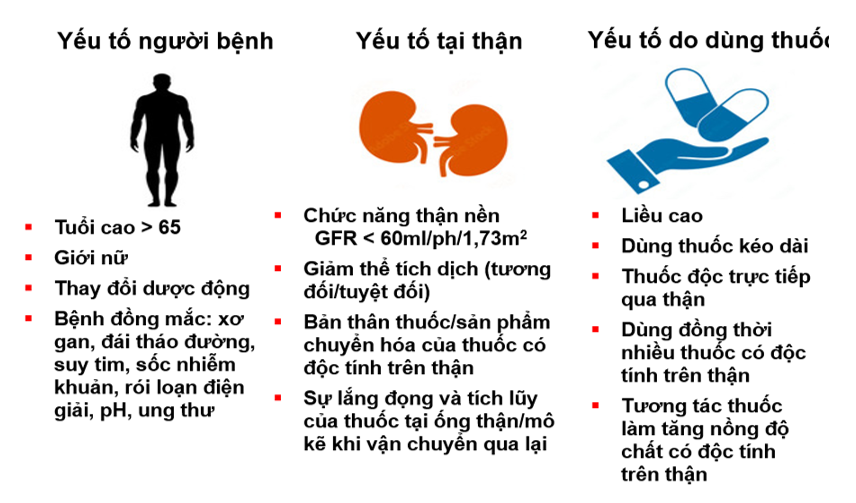
Hình 9. Các yếu tố nguy cơ gây AKI cần đánh giá trên bệnh nhân đang dùng thuốc có độc tính trên thận
Cần lưu ý rằng không phải mọi trường hợp gia tăng creatinin huyết thanh trên xét nghiệm đều thể hiện bệnh cảnh của tổn thương thận cấp. Một số thuốc có thể anh hưởng của thuốc đến kết quả creatinine nhưng không liên quan chức năng thận. Cụ thể các thuốc như trimethoprim, cimetidine, tazobactam có thể làm tăng creatinin máu do ức chế bài tiết creatinine; các thuốc như acid ascorbic, cephalosporin, levodopa, methyldopa có gây tăng creatinin máu do gây sai số trong đo nồng độ creatinin. Một ví dụ đang tranh cãi là nguy cơ AKI liên quan đến tương tác khi phối hợp giữa hai kháng sinh piperacillin/tazobactam và vancomycin. Một số nghiên cứu cho thấy sự gia tăng SCr trong trường hợp này do chức năng thận giảm bởi độc tính trực tiếp của cả hai thuốc tại ống thận. Tuy nhiên, một số nghiên cứu chỉ ra rằng sự gia tăng SCr có thể do giảm bài tiết creatinine gây ra bởi tazobactam (không kèm giảm độ lọc cầu thận) và không ảnh hưởng đến chức năng thận, điều này được gợi ý thông qua việc không có sự gia tăng nồng độ cystacin C (một dấu ấn sinh học khác về chức năng thận) trong quá trình sử dụng và phối hợp hai kháng sinh này.
3.2. Nguyên tắc giảm thiểu nguy cơ AKI liên quan đến thuốc
Các nguyên tắc chung cần đảm bảo khi sử dụng thuốc có độc tính trên thận cho bệnh nhân để hạn chế, phòng ngừa AKI gồm:
- Nếu có thể, cố gắng hạn chế sử dụng/phối hợp đồng thời các thuốc có độc tính trên thận
- Cân nhắc thay thế thuốc ít độc tính trên thận khi có thể nếu bệnh nhân có biểu hiện/dấu hiệu AKI trên lâm sàng hoặc kết quả xét nghiệm
- Cố gắng điều chỉnh các yếu tố thay đổi được: cân bằng dịch, chế độ ăn…
- Chú ý quản lý các bệnh lý đồng mắc (như suy tim, đái tháo đường)
- Theo dõi định kỳ SCr và chỉnh liều thuốc theo chức năng thận
- Giám sát nồng độ thuốc trong máu (TDM) nếu có thể đối với các thuốc độc cho thận và có khoảng trị liệu hẹp (như vancomycin, aminoglycosid, cyclosporin…)
Tuy nhiên, mỗi thuốc có thể có những biện pháp phòng ngừa đặc thù riêng, chẳng hạn như thuốc cản quang, thuốc tim mạch nhóm ức chế RAA, các thuốc kháng sinh (như vancomycin, amikacin, cotrimoxazol) hay các thuốc ức chế miễn dịch (cyclosporin, tacrolimus)
Cần tôn trọng các chống chỉ định của các thuốc trên bệnh nhân suy giảm chức năng thận với các mức lọc cầu thận khác nhau (như các thuốc hạ đường huyết đường uống) cũng như tránh các tương tác thuốc thúc đẩy các AKI như metformin và thuốc cản quang chứa iod trên các bệnh nhân có chức năng thận nền suy giảm.
Đơn vị Dược lâm sàng
KHOA DƯỢC
Tài liệu tham khảo
1. Chawla, L. S., Bellomo, R., Bihorac, A., Goldstein, S. L., Siew, E. D., Bagshaw, S. M., Bittleman, D., Cruz, D., Endre, Z., Fitzgerald, R. L., Forni, L., Kane-Gill, S. L., Hoste, E., Koyner, J., Liu, K. D., Macedo, E., Mehta, R., Murray, P., Nadim, M., Ostermann, M., … Acute Disease Quality Initiative Workgroup 16. (2017). Acute kidney disease and renal recovery: consensus report of the Acute Disease Quality Initiative (ADQI) 16 Workgroup. Nature reviews. Nephrology, 13(4), 241–257.
2. Makris K, Spanou L. Acute Kidney Injury: Definition, Pathophysiology and Clinical Phenotypes. Clin Biochem Rev. 2016;37(2):85-98.
3. Abuelo J. G. (2007). Normotensive ischemic acute renal failure. The New England journal of medicine, 357(8), 797–805.
4. Harężlak T, Religioni U, Szymański FM, et al. Drug Interactions Affecting Kidney Function: Beware of Health Threats from Triple Whammy. Adv Ther. 2022;39(1):140-147.
5. Mattioli I, Bettiol A, Crescioli G, et al. Hospitalisations Related to the Combination of ACE Inhibitors and/or Angiotensin Receptor Blockers with Diuretics and NSAIDs: A Post Hoc Analysis on the Risks Associated with Triple Whammy. Healthcare (Basel). 2023;11(2):238. Published 2023 Jan
6. Schoolwerth, A. C., Sica, D. A., Ballermann, B. J., Wilcox, C. S., & Council on the Kidney in Cardiovascular Disease and the Council for High Blood Pressure Research of the American Heart Association (2001). Renal considerations in angiotensin converting enzyme inhibitor therapy: a statement for healthcare professionals from the Council on the Kidney in Cardiovascular Disease and the Council for High Blood Pressure Research of the American Heart Association. Circulation, 104(16), 1985–1991.
7. Moake J. L. (2002). Thrombotic microangiopathies. The New England journal of medicine, 347(8), 589–600.
8. Yifan Z, Benxiang N, Zheng X, et al. Ceftriaxone Calcium Crystals Induce Acute Kidney Injury by NLRP3-Mediated Inflammation and Oxidative Stress Injury. Oxid Med Cell Longev. 2020;2020:6428498. Published 2020 Jul 9.
9. Mulay, S. R., Shi, C., Ma, X., & Anders, H. J. (2018). Novel Insights into Crystal-Induced Kidney Injury. Kidney diseases (Basel, Switzerland), 4(2), 49–57.
10. Lopes, J. A., & Jorge, S. (2013). The RIFLE and AKIN classifications for acute kidney injury: a critical and comprehensive review. Clinical kidney journal, 6(1), 8–14.
11. Miano, T. A., Hennessy, S., Yang, W., Dunn, T. G., Weisman, A. R., Oniyide, O., Agyekum, R. S., Turner, A. P., Ittner, C. A. G., Anderson, B. J., Wilson, F. P., Townsend, R., Reilly, J. P., Giannini, H. M., Cosgriff, C. V., Jones, T. K., Meyer, N. J., & Shashaty, M. G. S. (2022). Association of vancomycin plus piperacillin-tazobactam with early changes in creatinine versus cystatin C in critically ill adults: a prospective cohort study. Intensive care medicine, 48(9), 1144–1155.
12. Dobrek L. (2023). A Synopsis of Current Theories on Drug-Induced Nephrotoxicity. Life (Basel, Switzerland), 13(2), 325.