1. Ca lâm sàng
Người bệnh Nguyễn Văn T., nam, 60 tuổi, nhập viện vì vết loét nhiễm trùng ngón 1 bàn chân phải trên nền đái tháo đường type 2.
Chỉ số CLS khi nhập viện: WBC: 8.3 G/L
CRP: 21.9 mg/L
Chức năng thận: CrCl: 142 mL/phút (tính theo công thức Cockcroft-Gault)
Kết quả cấy dịch mủ bàn cân (sau 72 giờ): Proteus vulgaris
Dịch vết loét: Proteus mirabilis
Kháng sinh đồ: nhạy meropenem, piperacillin/tazobactam, amikacin, kháng các kháng sinh nhóm quinolon và cephalosporin thế hệ 3, 4.
Phác đồ điều trị ban đầu: Imipenem/cilastatin + amikacin.
Người bệnh vẫn còn sốt, lâm sàng vết loét bàn cân, bạch cầu và CRP chưa cải thiện sau 72 giờ đầu điều trị.
Vấn đề: Proteus spp., đặc biệt là Proteus mirabilis và Proteus vulgaris, có một số đặc điểm về kháng sinh đồ nội tại (intrinsic resistance) đối với imipenem, colistin và tigecyclin. Do đó imipenem/cilastatin không còn là lựa chọn phù hợp, cần chuyển đổi kháng sinh khác
2. Đề kháng nội tại của vi khuẩn đối với một số chủng vi khuẩn thường gặp và các cân nhắc trong lựa chọn và phối hợp kháng sinh
2.1. Đề kháng nội tại: đặc điểm và cơ chế
Ngoài đề kháng kháng sinh mắc phải do đột biến hoặc tiếp nhận gen đề kháng, các loại vi khuẩn còn có khả năng kháng nội tại với một số kháng sinh nhất định. Đề kháng tự nhiên hay đề kháng nội tại là một hiện tượng tự nhiên, sẵn có trong hệ gen của một số chủng vi khuẩn, có thể diễn ra theo nhiều cơ chế khác nhau và không phụ thuộc vào áp lực chọn lọc do kháng sinh. Điển hình là vi khuẩn Gram âm với lớp màng ngoài khó thấm và bơm tống đa thuốc (efflux pumps), làm giảm nồng độ nội bào của thuốc.
Vi khuẩn Gram âm có cấu trúc thành tế bào đặc biệt, tạo nên hàng rào vật lý và hóa học làm giảm đáng kể khả năng thấm thuốc. Hai yếu tố chính góp phần tạo nên đề kháng nội tại là:
Màng ngoài (Outer Membrane - OM):
- Cấu tạo bất đối xứng gồm lớp phospholipid ở mặt trong và lipopolysaccharid (LPS) ở mặt ngoài.
- LPS ngăn cản sự xâm nhập của các phân tử ưa lipid (hydrophobic), trong khi các porin chỉ cho phép các phân tử nhỏ <700 Da đi qua.
- Điều này làm hạn chế tác dụng của nhiều kháng sinh như macrolid, glycopeptid, lipopeptid, dù đích tác dụng của các thuốc này vẫn còn.
Bơm tống kháng sinh (Efflux pumps):
- Hệ thống bơm chủ động như AcrAB-TolC (E. coli), MexAB-OprM (P. aeruginosa) giúp loại bỏ kháng sinh ra khỏi tế bào, duy trì nồng độ thuốc nội bào ở mức thấp.
- Đây là một trong những yếu tố chính khiến nhiều thuốc không hiệu quả dù có thể thấm được phần nào qua OM.
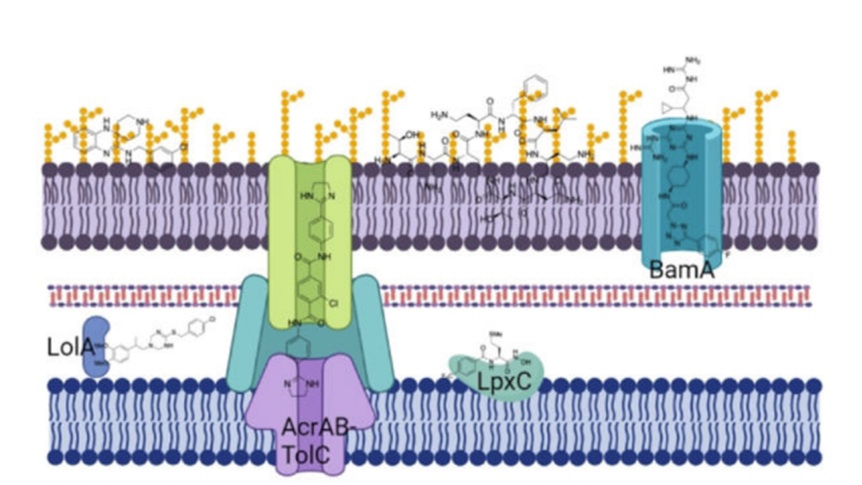
Hình 12.1. Cấu trúc màng tế bào của vi khuẩn gram âm
Một số cơ chế thúc đẩy đề kháng nội tại của một số chủng vi khuẩn đối với các kháng sinh bao gồm:
- Vi khuẩn Gram âm có lớp OM chứa lipopolysaccharide, giới hạn sự thấm của nhiều kháng sinh. Các porin như OprD ở P. aeruginosa khi bị giảm biểu hiện hoặc mất chức năng sẽ làm giảm khả năng thuốc xâm nhập, đặc biệt là carbapenem.
- Bơm tống thuốc là cơ chế chủ động đẩy kháng sinh ra khỏi tế bào. Hệ thống RND như MexAB-OprM (P. aeruginosa) và AcrAB-TolC (E. coli) giúp vi khuẩn kháng nhiều nhóm kháng sinh như β-lactam, quinolon và macrolid.
- Vi khuẩn có thể sản xuất enzyme như β-lactamase (AmpC, OXA), hoặc enzym sửa đổi aminoglycoside (aadK, aphD...) để thủy phân hoặc biến đổi cấu trúc thuốc, làm mất tác dụng.
- Đột biến trong các gen liên quan chuyển hóa lipid, acid amin hoặc tổng hợp thành tế bào (như gapA, lpxM) có thể làm thay đổi mức độ nhạy với kháng sinh, góp phần tạo nên kháng nội tại.
2.2. Đặc tính đề kháng nội tại của một số chủng gram âm đa kháng cần chú ý khi lựa chọn kháng sinh trên lâm sàng
2.2.1. Proteus spp.
Proteus spp. là vi khuẩn Gram âm thuộc họ Enterobacteriaceae, nổi bật với khả năng đề kháng kháng sinh nội tại đối với nhiều nhóm thuốc. Cơ chế chính bao gồm giảm tính thấm màng ngoài, hoạt động của bơm tống thuốc và enzyme β-lactamase nội tại (AmpC).
Các kháng sinh mà Proteus spp. đề kháng tự nhiên gồm: colistin, tigecycline, nitrofurantoin, và trong một số trường hợp là imipenem do giảm biểu hiện porin và tăng biểu hiện AmpC. Những đặc điểm này cần được cân nhắc khi lựa chọn kháng sinh điều trị nhiễm Proteus spp. trên lâm sàng.
2.2.2. Pseudomonas aeruginosa
Pseudomonas aeruginosa là vi khuẩn Gram âm có cơ chế đề kháng nội tại phức tạp và đa chiều. Cơ chế chủ chốt bao gồm màng ngoài ít thấm, trong đó các porin như OprD bị hạn chế biểu hiện hoặc biến đổi, khiến kháng sinh, đặc biệt là carbapenem như ertapenem khó thâm nhập vào tế bào.
Bên cạnh đó, hệ thống bơm tống đa thuốc (efflux pumps) như MexAB OprM, MexCD OprJ, MexEF OprN và MexXY OprM liên tục đẩy kháng sinh như β lactam, fluoroquinolon và aminoglycoside ra khỏi tế bào. Thêm vào đó, P. aeruginosa còn sản xuất enzyme nội tại như AmpC β lactamase giúp bất hoạt một số β lactam. Do vậy, vi khuẩn này thường kháng tự nhiên với nhiều kháng sinh như penicillin, cephalosporin. Việc lựa chọn kháng sinh có phổ tác dụng phù hợp là vấn đề cần lưu ý khi định hướng tác nhân này trong thực hành lâm sàng.
Hiện nay một số lựa chọn phù hợp cho P.aeruginosa (trừ các chủng khó điều trị - DTR) bao gồm ceftazidim, piperacillin/tazobactam, ciprofloxacin, levofloxacin, carbapenem (trừ ertapenem), các aminoglycosid và colistin. Tuy nhiên, tùy theo mô hình đề kháng kháng sinh tại chỗ và loại nhiễm khuẩn mà việc lựa chọn ưu tiên kháng sinh nào có thể được cân nhắc khác nhau.
2.2.3. Burkholderia cepaceae complex
Burkholderia cepacia complex (BCC) là nhóm vi khuẩn Gram âm không lên men với mức độ kháng nội tại rất cao, thể hiện qua nhiều cơ chế đồng thời.
Trước hết, BCC có lipopolysaccharide (LPS) biến đổi khiến colistin và polymyxin không thể gắn kết hoặc xuyên màng tế bào. Bên cạnh đó, các hệ thống bơm tống đa thuốc, đặc biệt thuộc họ RND được biểu hiện mạnh mẽ giúp đẩy nhiều nhóm kháng sinh khỏi tế bào, gây kháng nội tại với một số aminoglycosid, cephalosporin. Thêm vào đó, BCC có khả năng phân hủy hóa học hoặc bất hoạt thuốc, bao gồm cả enzyme β lactamase AmpC và các aminoglycoside-modifying enzyme, đồng thời thay đổi cấu trúc tế bào để giảm hấp thu fosfomycin, dẫn đến tất cả các chủng BCC đều kháng nội tại với fosfomycin.
Ngoài ra, BCC còn có khả năng chuyển hóa và phân giải các chất kháng khuẩn và chất sát khuẩn (ví dụ benzalkonium chlorid) thành các chất không độc, điều này vừa hỗ trợ đề kháng nội tại vừa duy trì khả năng tồn tại trong môi trường bệnh viện.
Một số lựa chọn kháng sinh phù hợp trong tiếp cận tác nhân này hiện nay bao gồm levofloxacin, TMP/SMX, ceftazidim, meropenem (dựa trên dữ liệu đề kháng, chế độ liều cần tối ưu theo PK/PD). Các trường hợp có mức độ đề kháng cao hơn có thể cân nhắc ceftazidim/avibactam, imipenem/relebactam và cefiderocol (tùy theo khả năng tiếp cận).
2.2.4. Stenotrophomonas maltophilia
Stenotrophomonas maltophilia là vi khuẩn Gram âm không lên men, nổi bật với đặc tính đa kháng nội tại, khiến điều trị nhiễm khuẩn bệnh viện trở nên khó khăn. Nguyên nhân chủ yếu gồm hai enzyme β lactamase nội bào là L1 (metallo β lactamase) và L2 (β lactamase nhóm A), gây kháng tự nhiên với hầu hết kháng sinh β lactam, kể cả carbapenem.
Đồng thời, hệ thống bơm tống đa thuốc mã hóa trên nhiễm sắc thể, như SmeDEF, SmeABC… loại bỏ hiệu quả nhiều nhóm thuốc, bao gồm β lactam, fluoroquinolon, macrolid, tetracyclin và chloramphenicol. Ngoài ra, S. maltophilia còn có các enzyme bất hoạt aminoglycoside và gen Qnr giúp kháng quinolon. Các cơ chế này kết hợp tạo nên một vi khuẩn nội tại đề kháng đa thuốc, hạn chế nghiêm trọng hiệu quả của nhiều phác đồ điều trị truyền thống.
Các lựa chọn điều trị có thể cân nhắc hiện nay đối với tác nhân này (tùy theo tình hình đề kháng tại chỗ) có thể bao gồm levofloxacin, moxifloxacin, TMP/SMX, minocyclin, cefiderocol.
Bảng 12.1. Đặc tính đề kháng nội tại của một số chủng gram âm thường gặp
3. Xử trí ca lâm sàng
3.1. Phân tích vấn đề
Người bệnh nhiễm Proteus mirabilis và Proteus vulgaris, hai chủng này đều có đề kháng nội tại với:
- Imipenem (do mất porin OprD và biểu hiện β-lactamase AmpC)
- Colistin, tigecycline (do đặc điểm màng ngoài và efflux)
Kháng sinh đồ cho thấy vi khuẩn còn nhạy cảm với các kháng sinh meropenem, piperacillin/tazobactam và amikacin.
Người bệnh không đáp ứng với imipenem/cilastatin + amikacin sau 72 giờ: sốt kéo dài, CRP cao, vết loét không cải thiện, chứng tỏ imipenem không hiệu quả lâm sàng, là một trường hợp của đề kháng nội tại.
3.2. Cân nhắc chuyển đổi với tối ưu hóa điều trị kháng sinh
Trong trường hợp này, ngưng imipenem/cilastatin có thể được cân nhắc do:
- Kháng nội tại không thể vượt qua bằng các tăng liều.
- Không có cải thiện lâm sàng dù phối hợp với amikacin.
Lựa chọn kháng sinh thay thế Piperacillin/tazobactam + Amikacin. Đây là phác đồ hợp lý dựa trên kết quả kháng sinh đồ, có tính hiệp đồng trên invitro để điều trị nhiễm khuẩn nặng do vi khuẩn gram âm đa kháng.
Dược sĩ lâm sàng có thể tư vấn chế độ liều piperacillin/tazobactam theo dược động học, dược lực học (PK/PD) để tối ưu hóa
- Liều khuyến nghị: 4,5 g mỗi 6 giờ
- Cách dùng: truyền kéo dài ≥3 giờ để tối ưu hóa %T > MIC ≥ 50%, đặc biệt quan trọng trong nhiễm trùng nặng.

Hình 12.2. Mẫu phiếu phân tích ca lâm sàng nhiễm khuẩn nặng do Proteus spp.
(Nguồn: Đơn vị Dược lâm sàng – thông tin thuốc, Bệnh viện Trường ĐHYD Cần Thơ)
3.3. Xây dựng kế hoạch chăm sóc dược cho người bệnh T.:
Theo dõi điều trị
- Lâm sàng: theo dõi sốt, tình trạng vết loét, đau/sưng đỏ quanh tổn thương
- Cận lâm sàng:
+ CRP và WBC sau 48–72 giờ để đánh giá đáp ứng
+ Creatinin máu để điều chỉnh liều amikacin, piperacillin/tazobactam
- Theo dõi độc tính:
+ Amikacin: chức năng thận, thính lực nếu dùng kéo dài
+ Piperacillin/tazobactam: theo dõi phản ứng dị ứng, tiêu hóa
4. Thông điệp lâm sàng
Đề kháng kháng sinh nội tại là một đặc tính sinh lý tự nhiên của nhiều chủng vi khuẩn Gram âm và Gram dương, bắt nguồn từ cấu trúc màng ngoài khó thấm, hệ thống bơm tống kháng sinh và sự hiện diện của các enzyme bất hoạt thuốc. Những yếu tố này khiến nhiều chủng vi khuẩn như Pseudomonas aeruginosa, Acinetobacter baumannii, Proteus spp., Burkholderia cepacia complex, Stenotrophomonas maltophilia kháng tự nhiên với nhiều nhóm kháng sinh phổ rộng như carbapenem (đặc biệt là imipenem), colistin, tigecycline, fosfomycin, nitrofurantoin, aminoglycoside.
Trong thực hành lâm sàng, nhận biết các mô hình kháng nội tại là yếu tố rất quan trọng để lựa chọn phác đồ kháng sinh hợp lý ngay từ đầu, tránh sử dụng kháng sinh không hiệu quả dù kháng sinh đồ có thể chưa có. Đồng thời, cần tối ưu hóa liều dùng dựa trên PK/PD, theo dõi sát lâm sàng và chức năng thận để đảm bảo hiệu quả và an toàn. Bên cạnh đó, tránh lạm dụng kháng sinh phổ rộng trong các ca chưa rõ nguyên nhân nhằm hạn chế áp lực chọn lọc làm tăng nguy cơ kháng mắc phải.
Việc phối hợp giữa bác sĩ điều trị, dược sĩ lâm sàng và vi sinh lâm sàng trong nhận diện đặc tính kháng nội tại và đọc – phân tích kháng sinh đồ đúng cách, từ đó nâng cao chất lượng quản lý nhiễm khuẩn Gram âm tại bệnh viện.
Tài liệu tham khảo
1. Miernik S, Matusiewicz A, Olesińska M. Drug-Induced Myopathies: A Comprehensive Review and Update. Biomedicines. 2024 Apr 30;12(5):987.
2. Melander RJ, Mattingly AE, Nemeth AM, Melander C. Overcoming intrinsic resistance in gram-negative bacteria using small molecule adjuvants. Bioorg Med Chem Lett. 2023 Jan 15;80:129113.
3. Reygaert WC. An overview of the antimicrobial resistance mechanisms of bacteria. AIMS Microbiol. 2018 Jun 26;4(3):482-501.
4. Kumar DN, Ghogale DS. Intrinsic resistance: A non-negligible bacterial trait. Ann Med Surg (Lond). 2022 Jun 3;78:103949.
5. Kumar N, Kumar H. Intrinsic Resistance: A Significant Characteristic in Evaluating Antibiotic Sensitivity Pattern [Letter]. Infect Drug Resist. 2022 Apr 5;15:1515-1516.
6. Girlich D, Bonnin RA, Dortet L, Naas T. Genetics of Acquired Antibiotic Resistance Genes in Proteus spp. Front Microbiol. 2020 Feb 21;11:256.
7. Breijyeh Z, Jubeh B, Karaman R. Resistance of Gram-Negative Bacteria to Current Antibacterial Agents and Approaches to Resolve It. Molecules. 2020 Mar 16;25(6):1340.
8. Rhodes KA, Schweizer HP. Antibiotic resistance in Burkholderia species. Drug Resist Updat. 2016 Sep;28:82-90.
9. Gil-Gil T, Martínez JL, Blanco P. Mechanisms of antimicrobial resistance in Stenotrophomonas maltophilia: a review of current knowledge. Expert Rev Anti Infect Ther. 2020 Apr;18(4):335-347.
10. Humphries R, Bobenchik AM, Hindler JA, Schuetz AN. Overview of Changes to the Clinical and Laboratory Standards Institute Performance Standards for Antimicrobial Susceptibility Testing, M100, 31st Edition. J Clin Microbiol. 2021 Nov 18;59(12):e0021321.
11. Rai S, Dash D, Agarwal N. Introducing the new face of CLSI M100 in 2023: An explanatory review. Indian J Med Microbiol. 2023 Nov-Dec;46:100432.
ThS.DS.Nguyễn Thiên Vũ
DSCKI. Huỳnh Ngọc Hoàn Mỹ
Đơn vị Dược lâm sàng-thông tin thuốc – Khoa Dược