1. Procalcitonin: bản chất và quá trình động học trong nhiễm khuẩn
Procalcitonin (PCT) là tiền chất của calcitonin, với bản chất polypeptid gồm 116 acid amin. Bình thường PCT tổng hợp bởi tế bào C của tuyến giáp, bài tiết vào huyết tương với nồng độ rất thấp (<0,05ng/ml).
Khi có tổn thương nặng, các tế bào khác như gan, phổi, bạch cầu… tăng tổng hợp và bài tiết tiết PCT thông qua sự kích thích của nội độc tố vi khuẩn, các cytokin tiền viêm, IL-6 và INF-a trong tình trạng cơ thể phản ứng với nhiễm trùng. Đối với tình trạng nhiễm virus, sự sản xuất procalcitonin được ngăn chặn bởi INF-a. Theo tổng quan hệ thống của Wacker và các cộng sự xem xét trên của 30 thử nghiệm lâm sàng với 3244 người bệnh sốc nhiễm trùng huyết trong ICU có theo dõi bằng PCT. Kết quả cho thấy PCT có độ nhạy với nhiễm khuẩn đạt 77% và độ đặc hiệu trong biểu hiện nhiễm khuẩn vào khoảng 79%.
Hình 1. Yếu tố kích thích sinh tổng hợp và bài tiết procalcitonin
(Sahu S et al. Sensors International 2 (2021))
Mức độ PCT thường tăng nhanh trong 3-6h đầu khi có tình trạng nhiễm khuẩn, đặc biệt là nhiễm khuẩn nặng và sốc nhiễm khuẩn. Đỉnh nồng độ của PCT đạt được trong vòng 12-24h và có xu hướng tỉ lệ thuận với mức độ nhiễm khuẩn. Do đó, về giá trị chẩn đoán, các nghiên cứu đầu thế kỷ XXI đồng thuận rằng PCT > 2ng/ml dự báo nguy cơ cao nhiễm khuẩn hệ thống và sốc nhiễm khuẩn. Trong huyết thanh, PCT có thời gian bán hủy là từ 19 đến 24 giờ và có xu hướng giảm nhanh trong trường hợp phác đồ kháng sinh phù hợp và đạt được đáp ứng lâm sàng. Bên cạnh độ nhạy và độ đặc hiệu cao, một ưu điểm khác của PCT là động học trong huyết tương không phụ thuộc vào chức năng thận (tuy nhiên khoảng tham chiếm có thể cần hiệu chỉnh trên bệnh nhân suy thận).
Hình 2. Liên quan giữa giá trị PCT và nguy cơ nhiễm khuẩn
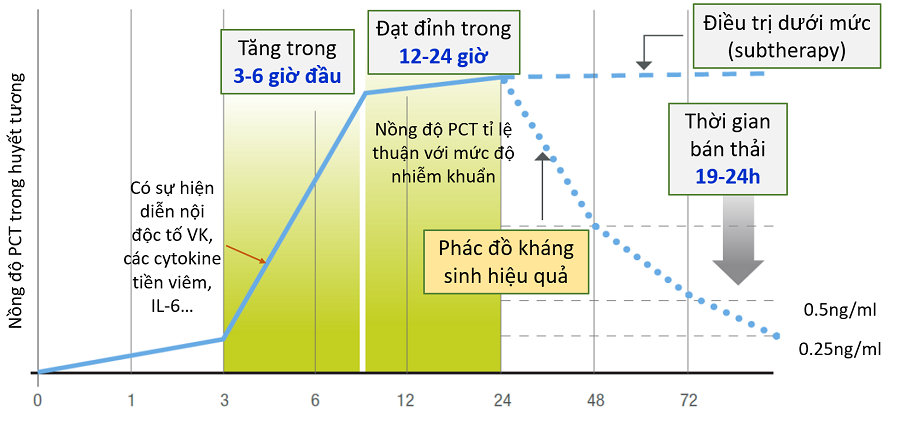
Hình 3. Động học procalcitonin trong quá trình nhiễm khuẩn
(Brunkhorst FM et al, Intensive Care Med 1998)
2. Vai trò và lợi ích của proclacitonin trong quản lý sử dụng kháng sinh
Khi điều trị kháng sinh, nếu không có bằng chứng về vi khuẩn sau 48-72 giờ kể tử khi bắt đầu điều trị hoặc thay đổi phác đồ, cần đánh giá lại lâm sàng trước khi quyết định tiếp tục sử dụng kháng sinh hay không.
Theo dõi đáp ứng bằng cách dấu ấn sinh học, như bạch cầu, CRP, procalcitonin, là một trong những phương pháp để quyết định điều trị tiếp tục hoặc dừng kháng sinh sớm, nhằm hạn chế tối đa biến cố bất lợi của thuốc cũng như các tổn hại phụ cận, nhưng vẫn đảm bảo đạt được hiệu quả lâm sàng và tránh nhiễm khuẩn tái phát. Trong các dấu ấn sinh học kể trên, có nhiều bằng chứng ủng hộ procalcitonin là dấu ấn sinh học đáng tin cậy trong đánh giá tình trạng nhiễm khuẩn, đặc biệt là trong quá trình sử dụng kháng sinh. Nhiều thử nghiệm lâm sàng hiện nay chứng tỏ thực hành dựa trên PCT giúp ngưng sớm kháng sinh, rút ngắn thời gian sử dụng trên những bệnh nhân nhiễm khuẩn nặng mà không ảnh hưởng đến kết cục lâm sàng. Bảng dưới đây hệ thống một số kết quả nghiên cứu về vai trò của PCT trong một số bệnh cảnh nhiễm khuẩn trên thế giới.
Bảng 1. Một số kết quả nghiên cứu về vai trò của PCT trong quản lý bệnh nhân nhiễm khuẩn nặng
Tác giả | Tạp chí
công bố | Cỡ mẫu | Đối tượng | Phương pháp nghiên cứu | Kết quả | Kết luận |
Assink-de Jong và cộng sự | The Lancet (2016) | 1575 | BN ICU | Thử nghiệm lâm sàng ngẫu nhiên có đối chứng (RCT) | DDD này giường là 7,5 (nhóm thử) < 9,3 (nhóm chứng) p < 0,001; thời gian điều trị 5 ngày (nhóm thử) < 7 ngày (nhóm chứng) p < 0,001. Tử vong ở ngày 28 là 20% (nhóm thử) < 27% (nhóm chứng) p = 0,0154; tử vong sau 1 năm 36% (nhóm thử) < 43% (nhóm chứng) p = 0,0188. | PCT giúp giảm thời gian điều trị, DDD trên bệnh nhân nặng đồng thời giảm tỉ lệ tử vong; PCT giúp BS quyết định duy trì chế độ kháng sinh tiếp tục không, cải thiện tính hợp lý phác đồ kháng sinh |
Kyriazopoulou và cộng sự | American Journal of Respiratory and Critical Care Medicine (2021) | 266 | Sepsis-3 | Thử nghiệm
ngẫu nhiên | Biến cố bất lợi liên quan đến nhiễm trùng là 7,2% (nhóm thử) thấp hơn có ý nghĩa so với 15,3% (nhóm chứng) p = 0,045; tử vong ngày 28 là 15,2% (nhóm thử) < 28,2% (nhóm chứng) p = 0,02; thời gian điều trị kháng sinh 5 ngày (nhóm thử) < 10 ngày (nhóm chứng) p < 0,001 | PCT giúp giảm biến cố bất lợi liên quan nhiễm khuẩn, cải thiện kết cục điều trị và rút ngắn thời gian dùng kháng sinh ở bệnh nhân sepsis |
Schuetz và
cộng sự | BioMed Central journal (2018) | 6708 | NK hô hấp cấp | Phân tích meta 71 bài báo | Thời gian điều trị kháng sinh 5,7 ngày (nhóm thử) < 8,1 ngày (nhóm chứng)
p < 0,0001; tác dụng phụ của kháng sinh 16% (nhóm thử) < 22% (nhóm chứng)
p < 0,0001 | PCT giúp giảm thời gian sử dụng/tiêu thụ kháng sinh và giảm tác dụng phụ của thuốc; có tiềm năng cải thiện kết cục lâm sàng |
3. Thực hành liên quan đến ứng dụng PCT trong đánh giá sử dụng kháng sinh và một số vấn đề chú ý
3.1. Nguyên tắc theo dõi đáp ứng của kháng sinh dựa vào PCT
Đến nay vẫn chưa có một phạm vi tham chiếu cố định và hướng dẫn chuẩn mang tính đồng thuận thế giới đối với ngưỡng nồng độ procalcitonin trong chẩn đoán nhiễm khuẩn. Do đó, y văn khuyến cáo rằng xét nghiệm procalcitonin chỉ hỗ trợ đánh giá tình trạng nhiễm trùng và cần phải có đánh giá trên lâm sàng của bác sĩ để đưa để loại trừ các yếu tố gây viêm khác và đưa ra chẩn đoán nhiễm trùng.
Đầu năm 2017, Cục Quản lý Dược Hoa Kỳ (FDA) đã phê duyệt cho phép sử dụng procalcitonin trong việc định hướng điều trị nhiễm khuẩn đối với nhiễm khuẩn hô hấp cấp, và nhiễm khuẩn có dấu hiệu sốc nhiễm trùng, hội chứng viêm hệ thống hay viêm phúc mạc. Tuy nhiên, theo dõi procalcitonin trong điều trị nhiễm khuẩn hiện chưa đủ bằng chứng khuyến cáo được áp dụng trên đối tượng suy giảm miễn dịch, phụ nữ mang thai, bệnh xơ nang, bệnh nhân viêm tụy. Bên cạnh đó, một số yếu tố như chấn thương, phẫu thuật,…có thể liên quan đến sự tăng nồng độ PCT không liên quan đến nhiễm khuẩn, có thể dẫn đến kết luận sai lầm trong điều trị.
Việc ứng dụng PCT đã cho thấy lợi ích rõ trong các chương trình quản lý sử dụng kháng sinh tại Hoa Kỳ và các nước châu Âu. Những bệnh nhân nghi ngờ nhiễm khuẩn hệ thống (đáp ứng viem toàn thân) hoặc nhiễm khuẩn huyết, bệnh nhân đang có nguy cơ đặc biệt (sau phẫu thuật, trung hoà miễn dịch...) là những bệnh nhân có thể nhận được lợi ích lớn nhất từ việc định lượng PCT theo dõi và điều chỉnh phác đồ điều trị dựa trên PCT.
Dưới góc nhìn quản lý sử dụng kháng sinh, procalcitonin có một số hướng tiếp cận trong ứng dụng chính, bao gồm:
- Định hướng khởi động kháng sinh:
Nồng độ PCT thấp có giá trị tiên lượng âm tính cao để loại trừ nhiễm khuẩn huyết và ngược lại, nồng độ PCT cao ủng hộ chẩn đoán nhiễm khuẩn
- Định hướng xuống thang kháng sinh hoặc ngưng kháng sinh: nồng độ PCT giảm dưới 0,5ng/ml hoặc dưới 80% so với đỉnh nồng độ ghi nhận được cho thấy đáp ứng tốt với phác đồ điều trị kháng sinh hiện tại.
- Định hướng liệu trình kháng sinh (bao gồm bắt đầu, thay đổi, xuống thang, ngưng)
Việc áp dụng PCT cho các mục đích cần cân nhắc các chứng cứ, các quy định, hướng dẫn của Bộ Y tế (bao gồm chính sách chi trả BHYT), của bệnh viện và kinh nghiệm lâm sàng của đội ngũ điều trị. Năm 2020, một lưu đồ áp dụng PCT cho bệnh nhân châu Á-Thái Bình Dương được đồng thuận, công bố trên tạp chí Clinical chemistry and laboratory medicine hướng dẫn như sau:
.png)
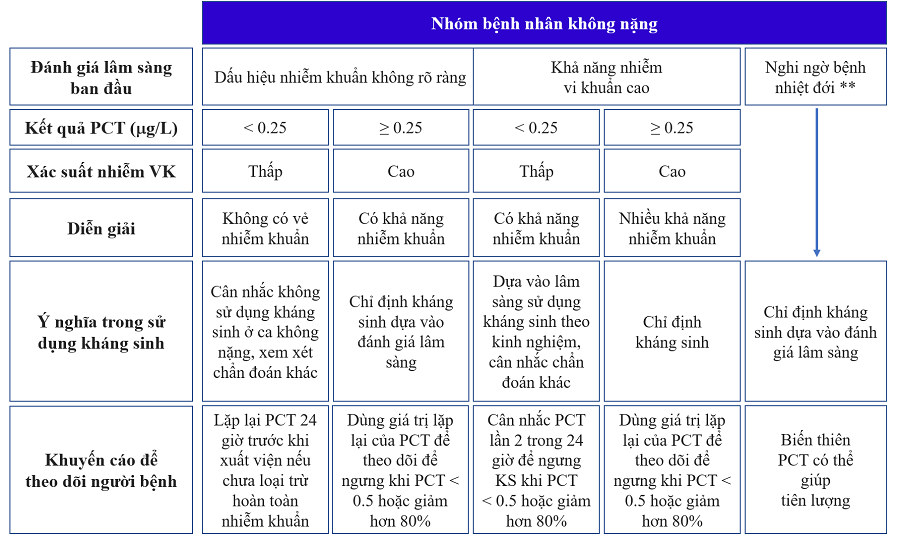
Hình 4. Lưu đồ theo dõi PCT để khởi động và ngừng kháng sinh trong thực hành lâm sàng (nguồn: Clin Chem Lab Med. 2020)
* Cân nhắc thận trọng trong trường hợp bệnh nhân có nhiều bệnh nền mạn tính
** Bệnh nhiệt đới bao gồm sốt rét, sốt xuất huyết, viêm màng não do não mô cầu, viêm não Nhật Bản, bệnh Rickettsia…
3.2. Lưu ý điều kiện chỉ định PCT trong bối cảnh thực tế tại Việt Nam
Hiện nay, PCT được xem là dấu ấn sinh học có nhiều ứng dụng trong chẩn đoán và theo dõi đáp ứng điều trị nhiễm khuẩn theo hướng dẫn sử dụng kháng sinh của BYT (2015) và các hướng dẫn chẩn đoán và điều trị khác.
Tuy nhiên, cần lưu ý khi chỉ định trong trường hợp thanh toán theo Bảo hiểm Y tế. Theo thông tư 50/2017/TT-BYT với các sửa đổi, bổ sung đối với điều kiện, tỷ lệ và mức giá thanh toán với dịch vụ kỹ thuật (DVKT), trong đó có định lượng PCT, được quy định như sau:
Bảng 2. Điều kiện thanh toán xét nghiệm PCT theo thông tư 50/2017
Điều kiện thanh toán | Tỷ lệ, mức giá thanh toán |
1. Chẩn đoán và theo dõi tình trạng nhiễm trùng nặng khi có một trong các dấu hiệu sau:
- SOFA ≥ 2
- Nghi ngờ có ổ nhiễm trùng và có 2 trong 3 tiêu chuẩn:
- Nhịp thở ≥ 22 lần/phút
- Huyết áp tâm thu ≤ 100mmHg
- Glasgow ≤ 13
2. Đối với trẻ em
- Chẩn đoán và theo dõi các trường hợp nhiễm trùng huyết
- Theo dõi và tiên lượng suy đa tạng khi có rối loạn chức năng từ 2 cơ quan trở lên
| Thanh toán bằng giá DVKT. Khi sử dụng xét nghiệm PCT để theo dõi tình trạng nhiễm trùng nặng và đáp ứng điều trị theo mục 1:
- Thanh toán tối đa 1 lần mỗi 24 giờ đối với sốc nhiễm trùng
- Thanh toán tối đa 1 lần mỗi 48 giờ đối với nhiễm trùng nặng
- Không thanh toán đối với các trường hợp không có dấu hiệu chỉ định và PCT ≤ 2 lần giá trị tham chiếu
|
Các trường hợp nhiễm khuẩn khác | Thanh toán theo giá DVKT định lượng CRP/CRP hs |
Trường hợp chỉ định DVKT định lượng CRP/CRP hs cùng thời điểm hoặc đã có kết quả PCT để chẩn đoán, theo dõi tình trạng nhiễm trùng nặng | Thanh toán DVKT PCT và không thanh toán DVKT định lượng CRP/CRP hs |
Ghi chú: giá trị tham chiếu của PCT là 0,05ng/ml. Như vậy kết quả PCT ≤ 0,1 được xem là không có khuyến cáo chỉ định dùng kháng sinh cũng như chỉ định PCT để theo dõi nhiễm khuẩn.
Đơn vị Dược lâm sàng – Thông tin thuốc – Khoa Dược
Tài liệu tham khảo:
1. Bộ Y tế (2015). Hướng dẫn sử dụng kháng sinh.
2. Bộ Y tế (2017), Thông tư 50/2017TT-BYT sửa đổi, bổ sung các quy định liên quan đến thanh toán chi phí khám bệnh, chữa bệnh
3. Hướng dẫn sử dụng kháng sinh BV Nhiệt đới Trung Ương (2020)
5. Gregoriano C, Heilmann E, Molitor A, Schuetz P. Role of procalcitonin use in the management of sepsis. J Thorac Dis. 2020;12(Suppl 1):S5-S15.
6. Wacker C, Prkno A, Brunkhorst FM, Schlattmann P. (2013). Procalcitonin as a diagnostic marker for sepsis: A systematic review and meta-analysis. Lancet Infect Dis, 13, pp. 426–435.
7. Brunkhorst FM et al: Kinetics of Procalcitonin in Iatrogenic Sepsis. Intensive Care Med 1998;24(8):888-889.
8. Liliana S, France G, Devendra KA et al (2004), Serum Procalcitonin and C-Reactive Protein Levels as Markers of Bacterial Infection: A Systematic Review and Meta-analysis, Clinical Infectious Diseases, Volume 39, Issue 2, 15 July 2004, Pages 206–217
9. Jacobs L, Wong HR. Emerging infection and sepsis biomarkers: will they change current therapies?. Expert Rev Anti Infect Ther. 2016;14(10):929-941.
10. Sahu S et al. Emerging evidence for serum procalcitonin estimation at point-of-care and advancement in quantitative sensing strategies over the past decade. Sensors International 2 (2021) 100107
11. Kyriazopoulou E, Liaskou-Antoniou L, Adamis G, et al. Procalcitonin to Reduce Long-Term Infection-associated Adverse Events in Sepsis. A Randomized Trial. Am J Respir Crit Care Med. 2021;203(2):202-210.
12. de Jong E, van Oers JA, Beishuizen A et al. Efficacy and safety of procalcitonin guidance in reducing the duration of antibiotic treatment in critically ill patients: a randomised, controlled, open-label trial. Lancet Infect Dis. 2016 Jul;16(7):819-827.
13. Schuetz P, Christ-Crain M, Wolbers M, et al. Procalcitonin guided antibiotic therapy and hospitalization in patients with lower respiratory tract infections: a prospective, multicenter, randomized controlled trial. BMC Health Serv Res. 2007;7:102. Published 2007 Jul 5.
14. Jung B, Molinari N, Nasri M, et al. Procalcitonin biomarker kinetics fails to predict treatment response in perioperative abdominal infection with septic shock. Crit Care. 2013;17(5):R255. Published 2013 Oct 24.
15. Jensen JU, Hein L, Lundgren B, et al. (2011), Procalcitonin-guided interventions against infections to increase early appropriate antibiotics and improve survival in the intensive care unit: A randomized trial. Crit Care Med, 39, pp. 2048–2058.
16. Lee CC, Kwa ALH, Apisarnthanarak A, Feng JY, Gluck EH, Ito A, Karuniawati A, Periyasamy P, Pratumvinit B, Sharma J, Solante R, Swaminathan S, Tyagi N, Vu DM, Zirpe K, Schuetz P. Procalcitonin (PCT)-guided antibiotic stewardship in Asia-Pacific countries: adaptation based on an expert consensus meeting. Clin Chem Lab Med. 2020 Nov 26;58(12):1983-1991.